T淋巴细胞(T lymphocyte)来源于胸腺(Thymus),故称T细胞。在人体胚胎期和初生期,骨髓中的一部分骨髓多能造血干细胞在骨髓中分化成淋巴样祖细胞,淋巴样祖细胞经过血液循环进入胸腺,并在胸腺中发育为成熟T细胞,成熟T细胞再经血液循环进入并定居在外周淋巴器官的胸腺依赖区,接受抗原刺激发生免疫应答。
一、T细胞在胸腺中的发育
正常机体的成熟T细胞既要对多样性的非我抗原发生免疫应答,又要对自身抗原发生免疫耐受。为达到此要求,在胸腺T细胞的发育过程中,首先要经历其抗原识别受体(TCR)的基因重排,表达多样性的TCR,然后经历阳性选择和阴性选择。因此,T细胞在胸腺中发育的最核心事件是获得多样性TCR的表达、自身MHC限制性(阳性选择)以及自身免疫耐受(阴性选择)的形成(图1)。
(一)T细胞在胸腺中的发育和TCR的重排
在胸腺微环境的影响下,T细胞的发育经历淋巴样祖细胞 → 祖T细胞(pro-T) → 前T细胞(pre-T) → 未成熟T细胞 → 成熟T细胞等阶段,不同阶段T细胞表达不同的表型和功能。依据CD4和CD8的表达,胸腺中的T细胞又可分为双阴性细胞(double negative cell,DN细胞)、双阳性细胞(double positive cell,DP细胞)和单阳性细胞(single positive cell,SP细胞)三个阶段。
1.CD4-CD8-双阴性细胞阶段
pre-T以前的T细胞均为DN细胞。其中pro-T开始重排TCR基因:γδT细胞重排γ和δ链基因:而αβT细胞重排β链基因,此处是γδT细胞和αβT细胞分化的分支点。在胸腺中。αβT细胞约占T细胞总数的95%-99%,γδT细胞约占1%-5%。αβT细胞表达的β链与前T细胞α链(pre-T cell α,pTα)组装成前TCR(pTα:β),成功表达前TCR的细胞即是pre-T。在IL-7等细胞因子的诱导下,pre-T增殖活跃,并表达CD4和CD8,细胞进人DP细胞阶段。
2.CD4+CD8+双阳性细胞阶段
DP的pre-T细胞停止增殖,开始重排α基因,并与β链组装成TCR(α:βTCR)。成功表达TCR的细胞即是未成熟T细胞。未成熟T细胞经历阳性选择并进一步分化为SP细胞。
3.CD4+CD8-或CD4-CD8+单阳性细胞阶段
SP细胞经历阴性选择后成为成熟T细胞,通过血液循环进人外周免疫器官。
(二)T细胞发育过程中的aβTCR基因重排
TCR基因群与BCR基因群的结构相似,其重排的过程也相似。TCRβ基因群包括Vβ、Dβ和Jβ三类基因片段。重排时先从Dβ和Jβ中各选1个片段.重排成D-J,然后与Vβ中的1个片段重排成V-D-J,再与Cβ重排成完整的β链,最后与pTα组装成前TCR,表达于pre-T表面。TCRα基因群包括Vα和Jα两类基因片段。重排时从Vα和Jα中各选1个片段,重排成V-J,再与Cα重排成完整的α链,最后与β链组装成完整的TCR,表达于未成熟T细胞表面。TCR的多样性形成机制主要是组合多样性和连接多样性但其N序列插人的几率远高于BCR和lg,故TCR的多样性可达1016,而此阶段的BCR多样性只有1011。
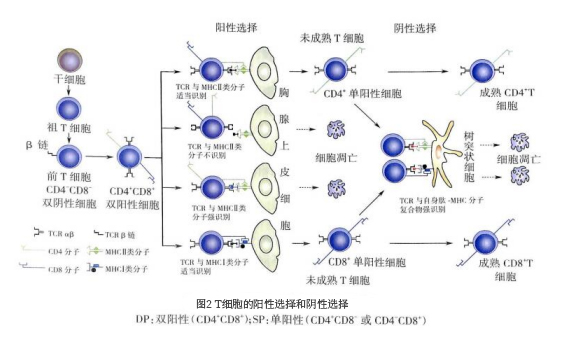
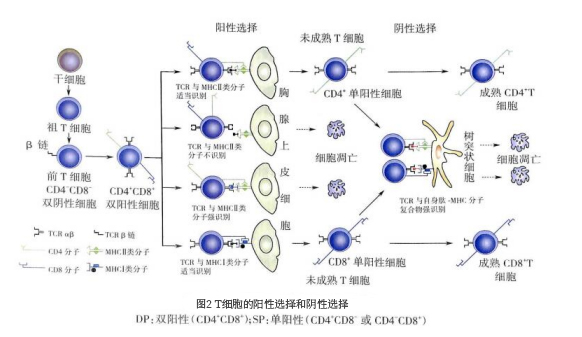
(三)T细胞发育过程中的阴性选择
阴性选择(negative selection)经过阳性选择的SP细胞在皮质髓质交界处及髓质区,与胸腺树突状细胞、巨噬细胞等表面的自身抗原肽 -MHC Ⅰ 类分子复合物或自身抗原肽 -MHC Ⅱ 类分子复合物相互作用。高亲和力结合的SP细胞(即自身反应性T细胞)发生调亡,少部分分化为调节性T细胞;而不能结合的SP细胞(阴性)存活成为成熟T细胞并进人外周免疫器官。因此,阴性选择的意义是清除自身反应性T细胞,保留多样性的抗原反应性T细胞,以维持T细胞的中枢免疫耐受。
经过胸腺发育的CD4+T细胞或CD8+T细胞,进人胸腺髓质区,成为能特异性识别抗原肽 -MHC Ⅱ 类分子复合物或抗原肽 -MHC Ⅰ 类分子复合物、具有自身MHC限制性以及自身免疫耐受性的初始T细胞,迁出胸腺,进人外周T细胞库(图2)。
二、T细胞在外周免疫器官中的增殖分化
从胸腺进人外周免疫器官尚未接触抗原的成熟T细胞称初始T细胞,主要定居于外周免疫器官的胸腺依赖区。T细胞的定居与它在胸腺发育中获得相应的淋巴细胞归巢受体(如L-选择素等黏附分子和CCR7等趋化因子受体)有关。T细胞在外周免疫器官与抗原接触后,最终分化为具有不同功能的效应T细胞亚群、调节性T细胞或记忆T细胞。


