B淋巴细胞(B lymphycyte,简称B细胞),来源于哺乳动物中枢免疫器官(即骨髓)的淋巴样干细胞(禽类是在法氏囊内分化发育而来);并且在骨髓内发育成熟。成熟B细胞离开骨髓,主要定居于外周免疫器官的淋巴滤泡内,约占外周淋巴细胞总数的20%。
B细胞在中枢免疫器官的分化发育主要包括功能性B细胞受体(B cell receptor,BCR)的表达和B细胞自身免疫耐受的形成。
一、B细胞在中枢免疫器官中的分化发育
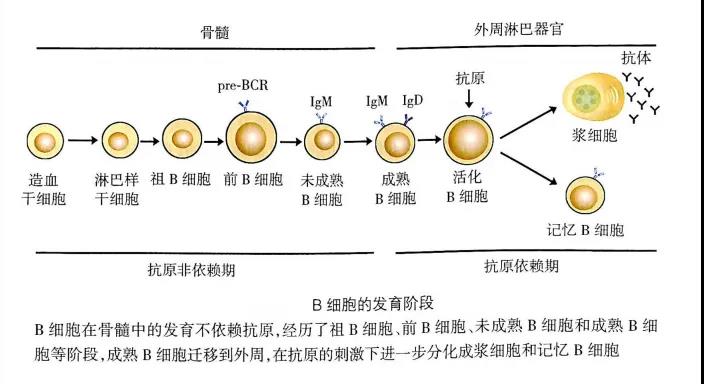
图片来源于(《医学免疫学》第6版)
B细胞在骨髓中的分化发育需经历祖B细胞、前B细胞、未成熟B细胞、成熟B细胞等几个阶段。
(一)祖B细胞(pro-B cell)
早期的pro-B开始重排重链可变区基因D-J,晚期pro-B的V-D-J基因发生重排,但此时没有mIgM(膜结合型免疫球蛋白M,BCR的主要成分)的表达。Pro-B开始表达Igα/Igβ异源二聚体(或称CD79a/CD79b),Igα和Igβ均属免疫球蛋白超家族,有胞外区、跨膜区和相对较长的胞质区;Igα和Igβ在胞外区的近胞膜处借助二硫键相连,构成二聚体;Igα/Igβ和mIg的跨膜区均有极性氨基酸,借静电吸引而组成稳定的BCR复合物。
Igα/Igβ胞质区含有免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motif,ITAM)。Igα/Igβ二聚体与膜型IgM相联,是BCR复合物的组成部分,其主要作用为接收IgM识别抗原后产生的第一信号,激活自身胞质区内的ITAM募集下游信号分子,向细胞内转导抗原与BCR结合所产生的信号,因此,Igα/Igβ异源二聚体是B细胞的重要标记。
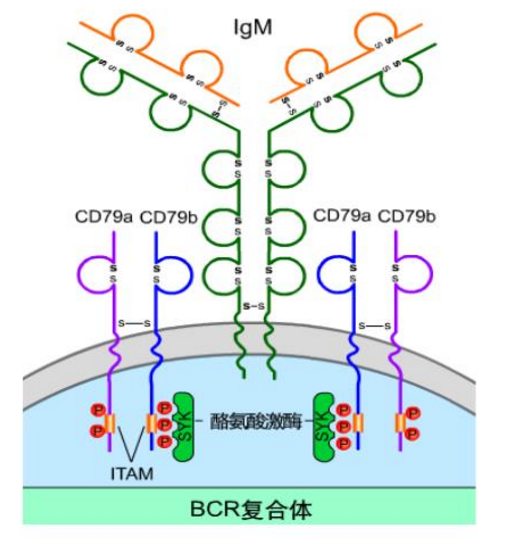
图片来源于网络(B细胞的发育与分化)
(二) 前B细胞(pre-B cell)前B细胞的特征是表达前B细胞受体(pre-BCR),并经历大pre-B和小pre-B两个阶段。Pre-BCR有μ链和替代轻链(surrogate light chain,包括分别与轻链V区和C区同源的Vpre-B和λ5两种蛋白)组成,可抑制另一条重链基因的重排(等位基因排斥),促进B细胞的增殖。大pre-B细胞进一步发育成为小pre-B细胞,小pre-B细胞开始发生轻链基因V-J重排,但依然不能表达功能性BCR。
(三)未成熟B细胞(immature B cell)
未成熟B细胞的特征是表达完整的重链和轻链,表达完整的BCR(mIgM),此时如受抗原刺激,则引发凋亡而导致克隆清除,B细胞自身免疫耐受便是在这个阶段形成。
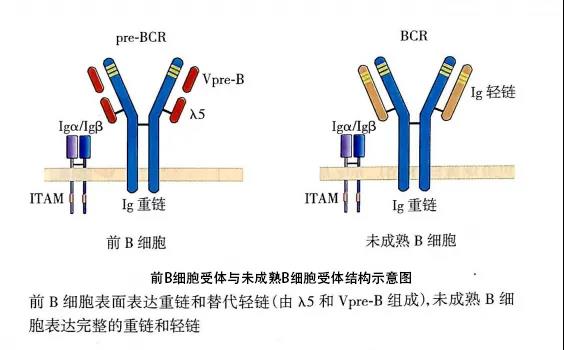
图片来源于(《医学免疫学》第6版)
(四)成熟B细胞,又称初始B细胞(mature B cell或者naive B cell)
成熟B细胞表面可同时表达mIgM和mIgD,其可变区完全相同。当未成熟B细胞发育为成熟B细胞后,便会离开骨髓,迁移并定居至外周免疫器官B细胞区;在外来抗原的刺激下,初始B细胞进一步活化、增殖,并分化为成熟浆细胞和记忆B细胞。
二、功能性BCR的表达
BCR受体是表达于B细胞表面的免疫球蛋白,即膜型免疫球蛋白(membrane immunoglobulin,mIg)。B细胞通过BCR识别抗原,接受抗原刺激,启动体液免疫应答。
(一)BCR受体的胚系基因结构
人免疫球蛋白(immunoglobulin,Ig)重链基因群位于第14号染色体长臂,由编码可变区(variable region,V区)的V基因片段(variable gene segment,VH)、D基因片段(diversity gene segment,DH)、J基因片段(joining gene segment,JH)以及编码恒定区(constant region,C区)的C基因片段组成。人Ig轻链基因群分为κ基因和λ基因,分别位于第2号染色体长臂和第22号染色体长臂,人轻链可变区基因只有V、J基因片段。
人Ig的基本结构是由两条完全相同的重链(heavy chain,H)和两条完全相同的轻链(light chain,L)通过二硫键连接的呈“Y”形的单体。人Ig重链与轻链都各自含有可变区与恒定区;可变区内,部分氨基酸组成和排列顺序高度可变(即基因层面的重新排列组合、受体编辑、Ig基因片段之间的插入、替换或缺失核苷酸等),这是B细胞能够产生数量巨大并能识别特异性抗原的BCR的主要原因。
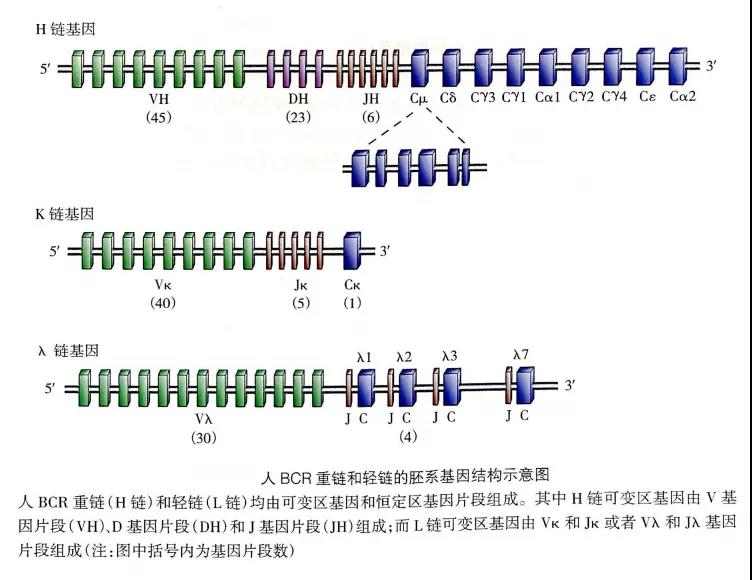
图片来源于(《医学免疫学》第6版)
(二)BCR受体的基因重排
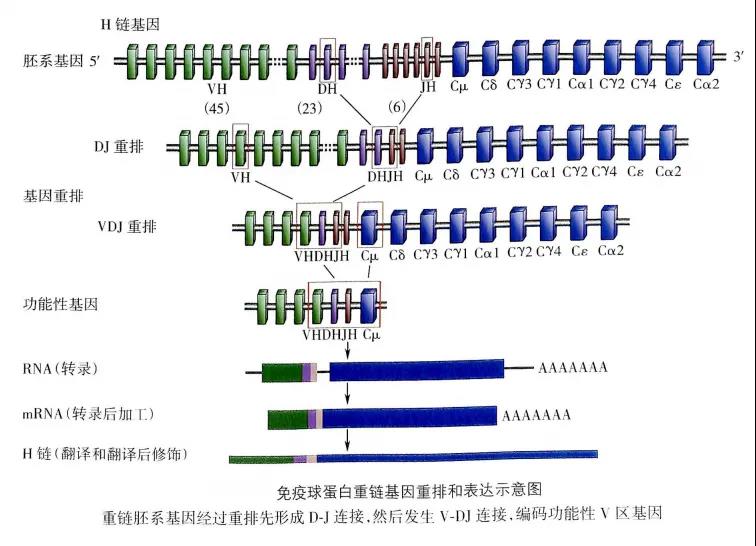
图片来源于(《医学免疫学》第6版)
B细胞还表达共受体复合物。B细胞共受体复合物由B细胞表面CD19/CD21/CD81非共价相联形成,主要作用是增强B细胞对抗原刺激的敏感性。CD19是所有B细胞共有的表面标志,参与启动信号转导、生发中心生成和抗体亲和力成熟。CD21主要表达于成熟B细胞,为C3d受体,也是B细胞上的EB病毒受体。CD81和B淋巴细胞的增值相关。
此外,B细胞还表达协同刺激受体:CD40、CD80、CD86,黏附分子:ICAM-1(CD54)、LFA-1(CD11a/CD18),及其他表面分子:CD20、CD22、CD32(FcγRⅡ)等。它们各自的作用或一或不一,均参与到机体免疫反应与调节中。
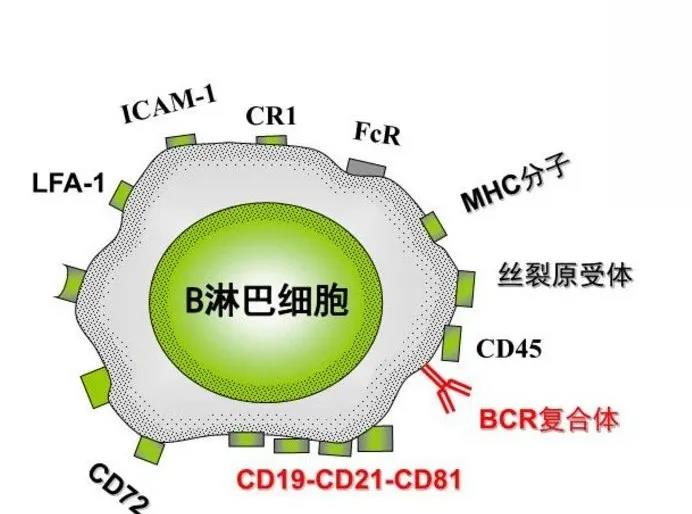
图片来源于网络(B细胞的发育与分化)
三、B细胞自身免疫耐受
基于克隆选择学说,机体自身的组织抗原成分在胚胎期就被相应的细胞克隆所识别,相应的未成熟淋巴细胞与机体自身抗原结合后被克隆删除,发生自身特异性免疫耐受,即赋予机体免疫系统区分“自我”和“非己”的能力。值得一提的是,在胚胎期任何进入机体的抗原都将被视作自身成分而产生免疫耐受。
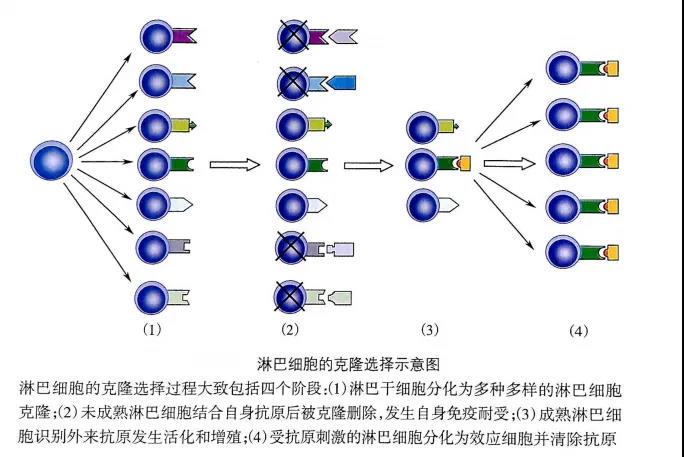
图片来源于(《医学免疫学》第6版)
前B细胞在骨髓中发育至未成熟B细胞后,其表面仅表达完整的mIgM。此时的mIgM若与骨髓中的自身抗原结合,一般会出现以下3类情形:
(1)克隆清除(clone deletion)。部分结合了自身抗原的B细胞,会在相关基因的调控及细胞因子的诱导下发生程序性死亡而被清除,从而使机体免疫系统形成区分“自我”与“非己”的能力,以便维护机体内环境稳定。
(2)受体编辑(receptor editing)。一些识别了自身抗原的未成熟B细胞会重新进行受体基因编辑,使BCR获得新的特异性。即由于一些识别自身抗原后的未成熟B细胞未被克隆清除,其RAG基因会重新活化,导致轻链VJ再次重排,合成新的轻链,替代自身反应性轻链,以避免自身性免疫反应的发生,亦即BCR获得新的特异性。
(3)失能(anergy)。在某些情况下,未成熟B细胞与自身抗原的结合可引起mIgM表达下调,这类细胞虽然可能进入外周免疫器官,但对抗原刺激不产生应答,此为失能。
克隆清除、受体编辑、失能等机制,使还在骨髓中发育的未成熟B细胞形成了对自身抗原的中枢免疫耐受,成熟B细胞到达外周淋巴组织后仅被外来抗原激活,发挥B细胞适应性免疫应答。
B细胞通过产生抗体的方式发挥特异性体液免疫应答(主要功能),同时也是专职性抗原提呈细胞(antigenpresenting cell,APC),对抗原进行摄取、加工与提呈,并且产生细胞因子参与机体免疫调节。
参考文献资料及图片来源:
《医学免疫学》第六版(曹雪涛)
B淋巴细胞的发育和分化(淘豆网)
百度百科


