肿瘤免疫治疗大概是目前最火热的创业和投资领域了,尤其是肿瘤免疫抗体药物和Car-T治疗领域。对于一个创新药物,需要经过一系列的临床前和临床试验,以证明其“有效”和“安全”,才能被批准上市并进入医生的处方里,肿瘤免疫抗体药物和Car-T也不例外。新药临床试验不管是成功还是失败,都是一项花费巨大的工程,这就需要我们尽可能全面地通过临床前试验来对这些新药进行评价,以提高临床成功率。找到最合适的动物模型,往往可以给我们提供最可靠的数据。在肿瘤免疫抗体药物和Car-T这种新型药物研发中,应该如何选择动物模型呢?
在选择体内药效评价模型方面,小鼠无疑是最常用的动物模型。首先,小鼠的繁殖快,可以快速得到有统计学意义的同周龄、同性别、且足量的小鼠;第二,有足够多的近交系小鼠肿瘤细胞系可以使用;第三,容易建立较稳定的动物-肿瘤模型体系,建立标准化的药效评价平台。
然而,通过对比小鼠和人基因序列发现,普通小鼠的很多基因与对应的人类基因之间,在蛋白氨基酸序列上同源性经常不是足够高。所以,一般情况下识别人蛋白的抗体,并不识别小鼠相应基因蛋白。也就是说,我们一般不能用普通小鼠来评价抗人蛋白抗体的药效。这就需要对小鼠的免疫检查点基因进行人源化改造。比如,将小鼠的PD1基因胞外部分换成人的对应部分,所得到的PD-1人源化小鼠可以用来做anti-human PD1抗体的药效评价。
这种基因编辑人源化小鼠模型的优势是,因为小鼠本身的免疫系统是完整的,非常适合针对同一靶点的不同单克隆抗体之间药效和毒性的精确比较。在R&D阶段找到药效最好、安全性最好的候选抗体,会提高最终抗体成药的成功率。
然而,毕竟人源化小鼠从制备、繁殖、鉴定评价、到成为药效验证的工具需要超过2年的时间,不是所有靶点都能有现成的基因编辑人源化小鼠,而且,有的研究者认为,通过人免疫系统重建之后的小鼠,也许跟人体真实情况更接近一些。利用重度免疫缺陷小鼠(如JAX的NSG,B-NDG小鼠等)进行免疫重建,也是一种可行的替代方案。
一种方法是将人的外周血单核细胞(PBMC)直接注射到重度免疫缺陷小鼠里进行免疫重建。其优势在于PBMC是已经发育成熟的免疫细胞,但由于PBMC的T细胞受体非特异识别小鼠的MHC,会导致人T细胞(尤其是CD8+ T细胞)在小鼠体内大量增殖,分泌大量的细胞因子,最终引起GvHD(移植物抗宿主反应),5-6周内导致小鼠体重下降和小鼠。如果在这种免疫重建的小鼠里接入肿瘤,由于体内大量活化的T细胞和细胞因子的存在,将使肿瘤免疫药效试验的结果非常复杂和不稳定,虽然可以做一些定性试验,但很难精确比较不同抗体的药效和安全性。
另一种方法是从脐带血中分离CD34+成血干细胞,注射到经过辐照或新生的重度免疫缺陷小鼠里。经过3-4个月的体内细胞发育分化,会得到人的免疫细胞。因为这种小鼠没有人T细胞发育所必需的人的胸腺,所以得到的免疫细胞免疫功能是有缺陷的,其体液免疫(B细胞免疫)也是有缺陷的。不过,这种方式得到的小鼠可以在一定程度上满足肿瘤免疫药物研发的需求,虽然实验结果不稳定,批间差比较大。
更复杂的方式是同时移植胎儿胸腺、胎肝和骨髓组织(即BLT模型),但是这种方法的成本将大大提高,也很难批量制备,适合于科学研究,却不适合于药物研发所要求的大批量、稳定和可重复的要求。
近几年,NSG和B-NDG这样的重度免疫缺陷小鼠也广泛用于Car-T的药效评价,也获得了不错的结果,尤其是针对B细胞淋巴瘤的Car-T试验。然而,虽然我们看到了B细胞淋巴瘤被Car-T细胞清除了,从免疫学的基本知识可以知道,Car-T在小鼠体内的行为方式跟人体内是不同的。
Car-T的制备过程是将患者自身T细胞进行体外激活并转染表达抗原(比如CD19,BCMA等)特异性抗体,然后再回输患者体内。也就是说,Car-T带有两种受体,即TCR和BCR(抗体)。做为自身T细胞,在没有抗原刺激的情况下,Car-T回输后在体内是不会扩增的(在忽略体外T细胞激活导致的瞬时体内增殖情况下),Car-T在体内扩增的动力主要是来源于Car-T上的抗体跟抗原的结合。在肿瘤细胞被清楚后,Car-T细胞群会迅速萎缩,或许留下一小部分Car-T记忆细胞。
然而,在免疫缺陷小鼠里,与PBMC类似,Car-T在免疫缺陷小鼠体内会通过其TCR被小鼠的MHC激活,造成Car-T的大量非特异性扩增,以及释放大量细胞因子。即使肿瘤细胞被Car-T清除之后,Car-T也不会像在人体内一样快速萎缩,而是会跟PBMC一样,继续增殖,从而导致GvHD。尤其在实体瘤研究方面,我们并不希望Car-T在小鼠体内大量非特异地增殖,从而影响实验结果的判断。因为在小鼠内,Car-T的激活和扩增并不主要是由肿瘤抗原推动的。所以,了解所用的小鼠并找到好的模型将会让我们更好的评价Car-T的药效以及安全性。
那有没有更好的模型呢?理论上,MHC缺失的免疫缺陷小鼠会更好一些。如果将PBMC注射到MHC缺失的小鼠里,PBMC里的T细胞就不会疯狂地增殖,从而将GvHD的发生时间很大程度的延迟。如果将PBMC和人的肿瘤接种到MHC缺失的重度免疫缺陷小鼠里,将会给研究者更长的实验窗口期,更好的模拟人体内的抗肿瘤免疫反应并进行药效研究。因为PBMC比脐带血CD34+细胞更容易获得,也将极大地提高制备效率和产能,满足医药研发所要求的大批量、稳定和可重复。
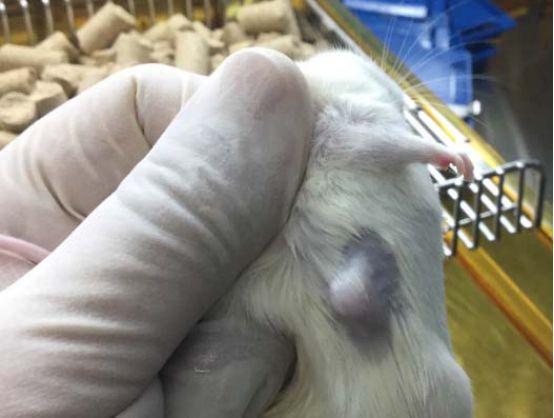
至少在MHC class I 缺失(b2m敲除)的B-NDG-b2m小鼠里,我们可以看到,接种PBMC+肿瘤的小鼠里,如果进行肿瘤免疫抗体药物处理,会看到肿瘤被抑制,同时在可观察的时间窗口内,没有见到体重下降(GvHD)。所以,在B-NDG-b2m小鼠里植入人肿瘤细胞,并注射人PBMC模型,所制备的模型可以更好的进行肿瘤免疫药物的药效评价。与脐带血CD34+细胞重建模型不同,PBMC重建小鼠里的免疫细胞功能是完善,而且还极大地缩短了模型制备时间。
B-NDG-b2m小鼠也非常适合于Car-T的药效研究。将人肿瘤细胞注射到小鼠体内,4天后给小鼠注射Car-T,可以看到肿瘤细胞被清除,同时,也可以看到血液中Car-T细胞数量的伴随下降。这说明Car-T细胞在MHC敲除小鼠里不会非特异地大规模增殖,更真实地模拟了人体内Car-T的作用方式。对于研究Car-T的安全性也具有更好的指导意义。
相信随着新模型的不断涌现,会找到更好的用于肿瘤免疫抗体和Car-T药效评价的人免疫系统重建小鼠模型。
雷德生物专业提供高活性,高标准,即用型的原代免疫细胞。严格按照GMP要求,根据标准的SOP规范制备;每批细胞都经过严格的质量控制,AO/PI荧光计数,流式细胞技术平台分析表面活性及特异性标记物含量;并提供细胞溯源信息,伦理知情同意书与生物安全性检查报告。

雷德生物目前产品销售范围主要集中在北上广深及主要省会城市,主要销售业务以免疫细胞为核心的免疫产品系列,围绕PBMC,CD4+,CD8+,CD14+,CD19+,Treg,NK等免疫细胞亚群产品和技术服务项目进行市场推广和营销网络建设,重要的客户群体集中在蛋白抗体药物研发企业和细胞免疫治疗企业及医疗机构,提供以免疫细胞功能分析为基础和特色的科研产品和技术服务项目,主要包括专用于生物大分子抗体药物研发筛选,药物毒理药效学分析,高通量免疫性疾病研究的标准化免疫细胞生物样本库,细胞治疗领域中的细胞功能分析的产品和服务,围绕世界500强医药研发中心,国内抗体药物研发企业,细胞治疗技术重点实验室等机构形成了较强的品牌影响力。


